Utilité des thérapies oncologiques
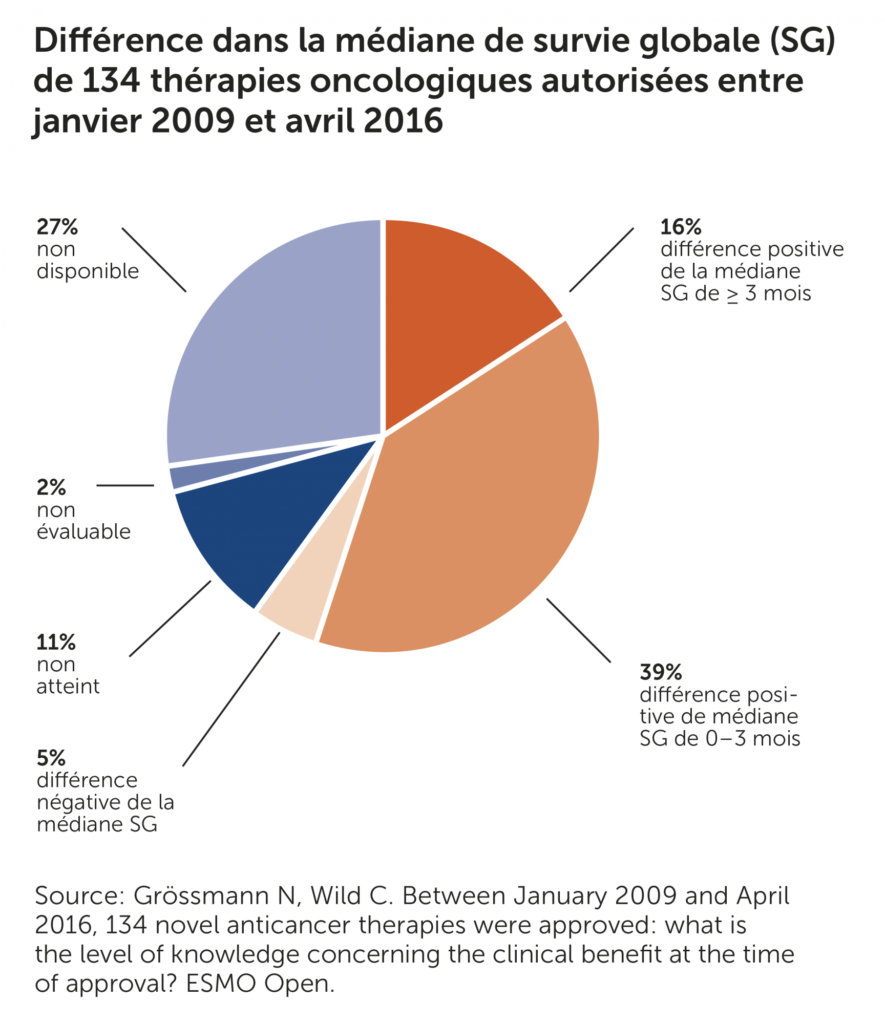
Ces dernières années, le nombre de procédures d’autorisation accélérées pour les médicaments en Europe a fortement augmenté [1–3]. Il en résulte non seulement une utilisation plus rapide de ces médicaments, mais aussi des incertitudes croissantes en ce qui concerne le bénéfice clinique au moment de l’autorisation. Selon une analyse transversale réalisée par le Ludwig Boltzmann Institut für Health Technology Assessment (LBI-HTA), les médicaments anticancéreux autorisés dans les années 2009 à 2016 ne fournissent dans 40% des cas aucune information sur la «médiane de survie globale» en tant que critère d’évaluation de l’étude. 39% des thérapies oncologiques prolongent la vie de 0 à 3 mois, 5% «réduisent » même la médiane de survie globale, et une prolongation de la vie supérieure à trois mois a été constatée dans seulement 16% des cas (cf. figure 1) [4].
Prise en charge de médicaments dans des cas particuliers
Les art. 71a à 71d de l’OAMal ont été prévus pour aider à trouver des solutions. Grâce à eux, les assureurs-maladie doivent pouvoir rembourser des médicaments dans des cas exceptionnels. Cette réglementation initialement judicieuse et pragmatique a connu une dérive.

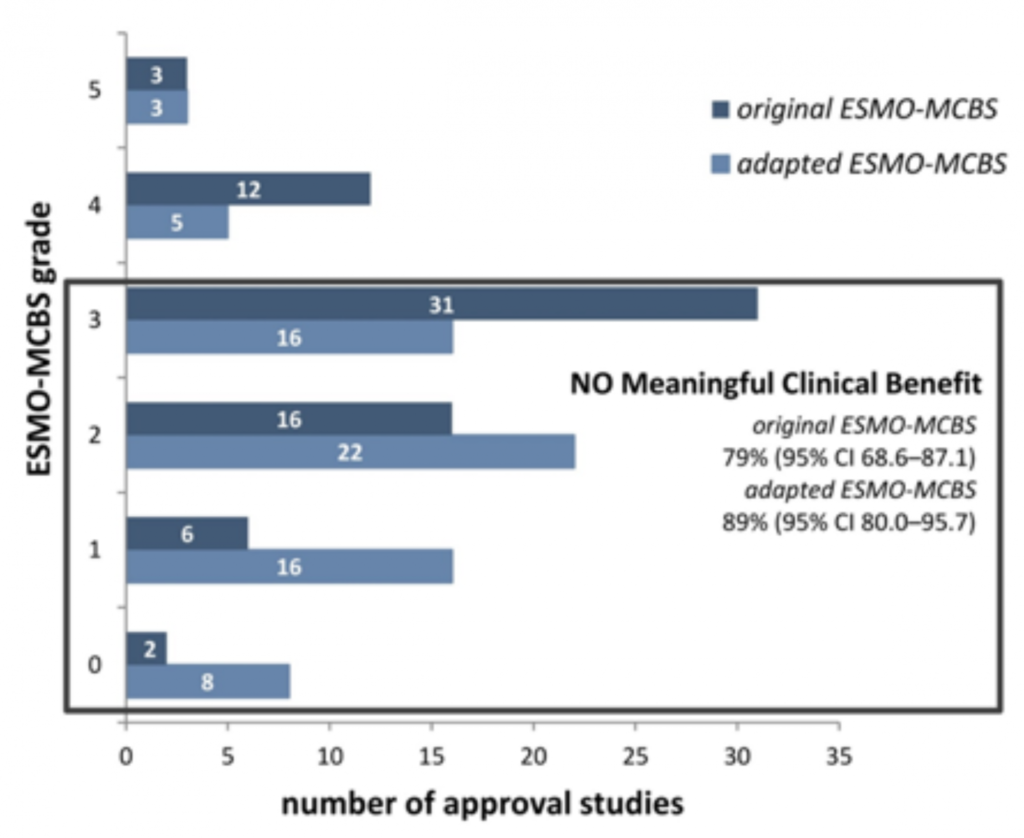
Bien souvent, l’autorisation ne repose que sur les seuls paramètres de substitution pourtant contestés. Formulé plus simplement, on cherche ici à déterminer si un effet peut être obtenu, mais pas s’il y a vraiment un impact (positif) sur la mortalité. Cela réduit certes les coûts des études en raison des durées plus courtes et des effectifs de patients plus petits. Néanmoins, l’incertitude augmente du point de vue du risque de bénéfice effectif des médicaments [5]. En raison des critiques internationales relatives à la faible utilité des médicaments anticancéreux (souvent très onéreux), non seulement les organismes-payeurs et les instituts HTA, mais aussi les sociétés d’oncologie, au nombre desquelles la European Society for Medical Oncology (ESMO), ont développé des instruments d’évaluation du bénéfice clinique [6–8]. Même si l’échelle d’évaluation de l’ESMO (Magnitude of Clinical Benefit Scale MCBS) tient déjà compte des effets secondaires et de la qualité de vie, ces critères ont été pondérés davantage dans une version adaptée pour l’utilisation dans le domaine HTA afin d’accorder plus d’importance aux paramètres pertinents pour les patients [8, 9]. Dans une étude du LBI-HTA de 2017, 70 thérapies pour le traitement de tumeurs solides ayant été autorisées par l’Agence européenne des médicaments (EMA) entre 2011 et 2016 ont été analysées [10]. Parmi celles-ci, seules 21% ont atteint la valeur seuil correspondant au «meaningful clinical benefit» (MCB), calculé avec l’échelle originale, et au moyen de la version adaptée, c’était le cas pour seulement 11% des médicaments (cf. figure 2).
On peut supposer qu’en raison du nombre accru de procédures d’autorisation accélérées, les exigences de l’autorisation EMA diminueront. C’est pourquoi le bénéfice clinique des thérapies oncologiques devrait régulièrement être déterminé pour garantir la répartition équitable des ressources de santé limitées.
Sources
- Banzi R, Gerardi C, Bertele V, Garattini S. Approvals of drugs with uncertain benefit-risk profiles in Europe. European journal of internal medicine. 2015;26(8):572-84.
- Vella Bonanno P, Ermisch M, Godman B, Martin AP, Van Den Bergh J, Bezmelnitsyna L, et al. Adaptive Pathways: Possible Next Steps for Payers in Preparation for Their Potential Implementation. Frontiers in pharmacology. 2017;8:497.
- Grössmann N, Robausch M, Rosian K, Wild C, Simon J. Monitoring evidence on overall survival benefits of anticancer drugs approved by the European Medicines Agency between 2009 and 2015. European Journal of Cancer. 2019;110:1-7.
- Grössmann N, Wild C. Between January 2009 and April 2016, 134 novel anticancer therapies were approved: what is the level of knowledge concerning the clinical benefit at the time of approval? ESMO Open. 2016;1(6):esmoopen-2016-000125.
- Kim C, Prasad V. Cancer Drugs Approved on the Basis of a Surrogate End Point and Subsequent Overall Survival: An Analysis of 5 Years of US Food and Drug Administration Approvals. JAMA internal medicine. 2015;175(12):1992-4.
- Cohen D. Cancer drugs: high price, uncertain value. BMJ. 2017;359:j4543.
- Schnipper LE, Davidson NE, Wollins DS, Tyne C, Blayney DW, Blum D, et al. American Society of Clinical Oncology Statement: A Conceptual Framework to Assess the Value of Cancer Treatment Options. Journal of Clinical Oncology. 2015;33(23):2563-77.
- Cherny NI, Sullivan R, Dafni U, Kerst JM, Sobrero A, Zielinski C, et al. A standardised, generic, validated approach to stratify the magnitude of clinical benefit that can be anticipated from anti-cancer therapies: the European Society for Medical Oncology Magnitude of Clinical Benefit Scale (ESMO-MCBS). Annals of Oncology. 2016;28(11):2901-5.
- Wild C, Grossmann N, Bonanno PV, Bucsics A, Furst J, Garuoliene K, et al. Utilisation of the ESMO-MCBS in practice of HTA. Annals of oncology : official journal of the European Society for Medical Oncology. 2016;27(11):2134-6. Epub 2016/10/30.
- Grössmann N, Del Paggio JC, Wolf S, Sullivan R, Booth CM, Rosian K, et al. Five years of EMA-approved systemic cancer therapies for solid tumours-a comparison of two thresholds for meaningful clinical benefit. European journal of cancer (Oxford, England : 1990). 2017;82:66-71.




